Nuestro cuerpo alberga un ejército letal. ¿Qué impide que se vuelva contra nosotros? El Premio Nobel de Fisiología o Medicina 2025 celebra a los tres científicos que descubrieron a los ‘reguladores’ de este nuestro sistema de defensa: Mary E. Brunkow, Fred Ramsdell y Shimon Sakaguchi. El galardón, anunciado el 6 de octubre de 2025, reconoce sus descubrimientos sobre la «tolerancia inmune periférica», un mecanismo de control crucial que evita que nuestro propio sistema inmunitario ataque a nuestras células por error.
Identificaron a las células T reguladoras, una clase de linfocitos que actúan como los «supervisores» de nuestro sistema inmunitario.
En palabras de Olle Kämpe, presidente del Comité Nobel: «Sus descubrimientos han sido decisivos para nuestra comprensión de cómo funciona el sistema inmunológico y por qué no todos desarrollamos enfermedades autoinmunes graves».
Este premio celebra un avance que ha abierto un campo completamente nuevo en la inmunología, con implicaciones directas en el tratamiento del cáncer y las enfermedades autoinmunes.
En Nuestro Ejército inmunológico: ¿Quiénes son los Soldados?
Dentro de cada uno de nosotros existe un ejército formado por millones de células: el sistema inmunitario. Su misión es defendernos de patógenos como virus, bacterias y toxinas. Sin embargo, este ejército se enfrenta a un desafío monumental: ¿cómo puede reconocer y destruir a los invasores sin atacar a las células sanas de nuestro propio organismo? La respuesta a esta pregunta reside en un concepto clave llamado tolerancia.
Los soldados de élite de este ejército son los linfocitos T, o células T. Su función principal es identificar y eliminar patógenos o células infectadas. El proceso de reconocimiento es ingenioso. Unas células especializadas, conocidas como «células presentadoras de antígenos», actúan como los «ojos» del sistema. Estas células capturan a los invasores, los descomponen en pequeños fragmentos llamados antígenos, que funcionan como un «documento de identidad del patógeno». Al presentar estos antígenos en su superficie, permiten que los linfocitos T identifiquen al enemigo y lancen un ataque preciso para destruirlo.
El Examen a Vida o Muerte en el Timo: La Antigua Teoría
Los linfocitos T se producen en la médula ósea, pero no nacen listos para la batalla. Deben viajar a un pequeño órgano situado entre el corazón y el esternón, el timo, para madurar. Durante décadas, la inmunología se basó en la creencia de que en el timo tenía lugar un riguroso proceso de selección llamado tolerancia central, una especie de «examen a vida o muerte».
La regla del examen era simple: si un linfocito T en desarrollo reconocía un antígeno propio del cuerpo, era eliminado. Si no lo hacía, sobrevivía y se le permitía circular por el torrente sanguíneo. El objetivo de esta selección era purgar el ejército de cualquier célula T que pudiera volverse contra el propio organismo y causar una enfermedad autoinmune. Durante mucho tiempo, la comunidad científica creyó que este sistema era suficiente para garantizar la paz interior. Pero la realidad clínica, con millones de personas sufriendo enfermedades autoinmunes, sugería que algunas células rebeldes debían estar escapando de este examen.

De interés en Ondas y Partículas:
Resumen de la guía AHA 2025: Manejo de hipertensión arterial en adultos
La Pieza Perdida: El Descubrimiento que Nadó Contracorriente
En 1995, el trabajo de Shimon Sakaguchi comenzó a nadar contracorriente, desafiando el dogma establecido. Su experimento clave fue tan elegante como revelador:
- Al extirpar el timo de un ratón, este, como era de esperar, desarrollaba enfermedades autoinmunes porque el «examen» de tolerancia central no se llevaba a cabo.
- Sin embargo, si a ese mismo ratón sin timo se le inyectaban células T procedentes de un ratón sano (con timo), el animal no enfermaba.
La conclusión de Sakaguchi fue revolucionaria, casi herética para la inmunología de la época: debía existir otro sistema de control activo en la periferia, más allá del timo. Tras años de investigación, identificó un receptor único, el CD25, presente solo en un pequeño subgrupo de linfocitos T. Al inyectar únicamente estas células T con CD25 en ratones, estos se mantenían sanos. Pero si inyectaba las células T que carecían del receptor, los ratones enfermaban. Había descubierto a los supervisores del sistema inmune, a los que llamó «Linfocitos T regulatorios» o Treg. Este descubrimiento suponía un «cambio de paradigma tan grande» que la comunidad científica no aceptó sus resultados de inmediato.
Mientras la comunidad científica debatía los hallazgos de Sakaguchi, la respuesta definitiva no vendría de un laboratorio de inmunología, sino de la genética, a través de una misteriosa cepa de ratones enfermos.
Una Mutación Reveladora: Encontrando el ‘Interruptor Maestro’ Genético
En 2001, Mary E. Brunkow y Fred Ramsdell investigaban una misteriosa cepa de ratones apodados «scurfy» («casposos» o «escamosos») por el mal estado de su piel. Estos ratones sufrían una grave enfermedad autoinmune a pesar de tener un timo perfectamente funcional, lo que apuntaba a un fallo en otro mecanismo de control. Esta condición era sorprendentemente similar a un trastorno humano raro y grave conocido como síndrome IPEX, que causa eccemas severos, diabetes y otros problemas autoinmunes.
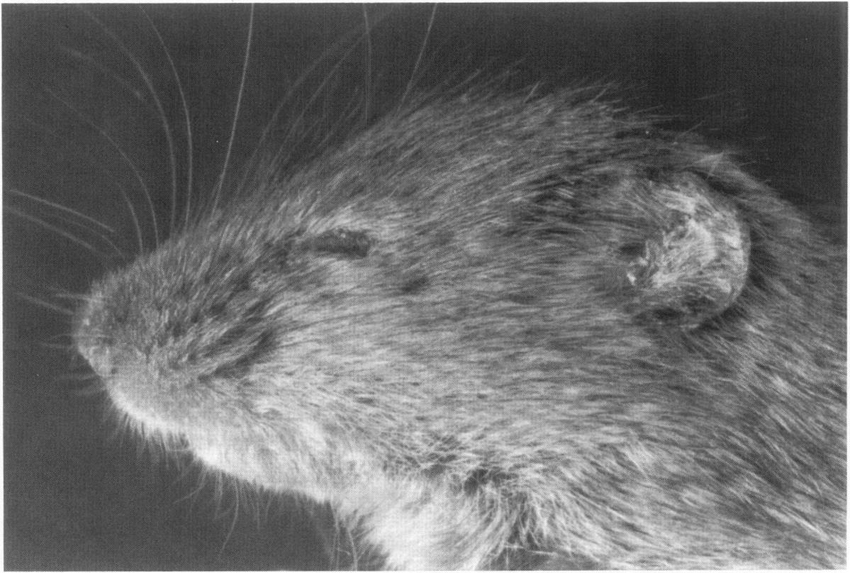
Estudiando el genoma de los ratones ‘scurfy’, Brunkow y Ramsdell se embarcaron en una cacería genética. Tras analizar gen por gen una región sospechosa, la respuesta apareció en el último de una lista de 20 candidatos: una mutación en un gen que bautizaron como Foxp3. Inmediatamente, buscaron y encontraron la misma mutación en el genoma de pacientes con síndrome IPEX.
El círculo se cerró magistralmente en 2003. Fue entonces cuando Shimon Sakaguchi, en un trabajo posterior, demostró que el gen Foxp3 era, precisamente, el ‘interruptor maestro’ genético que gobierna el desarrollo y la función de las células T reguladoras que él había identificado casi una década antes. La pieza genética perdida había encajado en el puzle inmunológico.
¿Por Qué Este Descubrimiento lo Cambia Todo?
El trabajo conjunto de los tres laureados revolucionó por completo nuestra comprensión del sistema inmunitario, estableciendo el concepto de tolerancia periférica.
- ¿Cómo funcionan?: Las células Treg actúan como «pacificadores». Cuando un linfocito T «rebelde» escapa del examen del timo y comienza a atacar a las células del propio cuerpo, las Treg se acercan a él y lo «calman» mediante señales celulares y contacto directo, deteniendo el ataque.
- ¿Qué significa esto?: El cuerpo posee un segundo y crucial nivel de seguridad. La tolerancia periférica, mediada por las Treg, funciona como una patrulla que controla activamente a las células T en circulación, asegurando que no se vuelvan contra nosotros.
- ¿Por qué es importante?: Este mecanismo explica por fin la raíz de muchas enfermedades autoinmunes, como la esclerosis múltiple, la diabetes tipo I o la artritis reumatoide, que ocurren cuando este sistema de control falla.
Este conocimiento ha dado lugar a nuevas y prometedoras estrategias terapéuticas:
- Tratamiento de enfermedades autoinmunes y rechazo de trasplantes: En estos casos, el objetivo es aumentar el número o la eficacia de las células Treg. Esto se puede lograr inyectando factores de crecimiento que las estimulen o extrayendo las células del propio paciente, multiplicándolas en un laboratorio y reinyectándolas.
- Lucha contra el cáncer: Paradójicamente, aquí se investiga lo contrario: disminuir la actividad de las células Treg. La razón es que algunos tumores son maestros del engaño; emiten señales químicas que ‘confunden’ a las Treg, reclutándolas como guardaespaldas involuntarias que ordenan al resto del sistema inmunitario que no ataque. Al inhibir estas Treg ‘engañadas’, se libera al ejército inmunitario para que pueda reconocer y destruir las células cancerígenas.
Estos descubrimientos no solo resolvieron un enigma biológico, sino que lanzaron un nuevo campo en la inmunología que ya ha salvado, y salvará, muchas vidas.
Un Futuro de Posibilidades
El trabajo de Brunkow, Ramsdell y Sakaguchi nos ha desvelado cómo nuestro «ejército personal» es dirigido y controlado con una precisión asombrosa. Hemos pasado de creer en un único punto de control a entender una compleja red de vigilancia y pacificación liderada por las células T reguladoras.
Este nuevo mapa del territorio inmunitario no solo resuelve un misterio biológico, sino que nos entrega las herramientas para redibujar el futuro de la medicina, un avance que, como celebran desde el Comité Nobel, ya está empezando a «devolver vida a miles de pacientes en todo el mundo».
Referencias
Nobel Prize Official Site
The Nobel Prize. (2025, octubre 6). The Nobel Prize in Physiology or Medicine 2025 – Press release. https://www.nobelprize.org/prizes/medicine/2025/press-release/